東京大学、ヒトがL-グルタミン酸に強い旨みを感じる仕組みを解明
同成果は、同大大学院農学生命科学研究科の戸田安香 共同研究員、同 博士課程の中北智哉氏、同 岡田晋治 助教、同 成川真隆 特任教授、同 石丸喜朗 特任教授、同 三坂巧 准教授、京都大学 霊長類研究所 博士課程の早川卓志氏、同 今井啓雄 准教授らによるもの。詳細は米国生化学分子生物学会の学術誌「The Journal of Biological Chemistry」 に掲載された。
「旨味(umami)」は、昆布だしの主成分であるL-グルタミン酸がもたらす味であり、現在では、甘味・苦味・酸味・塩味と並ぶ基本五味の1つとして、国際的に認められている。旨味物質を受容する味覚受容体として複数の候補分子が知られており、その中でT1R1/T1R3は、旨味感覚に特有な「アミノ酸と核酸との旨味相乗効果」を媒介する重要な受容体として機能している。
これまでの研究から、T1R1/T1R3が受け取るアミノ酸の種類には、動物種間で大きな差が認められることが報告されていたが、その差がどういったメカニズムによって生じているのかは不明となっていた。そこで研究グループは今回、その謎の解明に向け、T1R1/T1R3が受容するアミノ酸の種類が何によって決定されるのかについての分子メカニズムの検証を行ったという。
具体的には、多種類のヒト-マウスのキメラ受容体・点変異体におけるアミノ酸応答パターンを調べることで、ヒト型の「L-グルタミン酸受容に重要な残基」とマウス型の「幅広いアミノ酸を受容するために重要な残基」を同定することを試みたという。
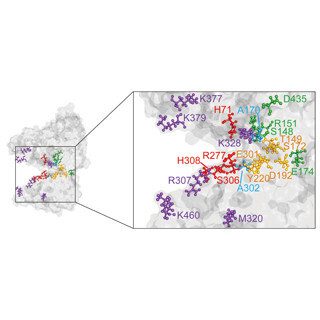
その結果、T1R1サブユニット内に、それぞれの機能に重要な6残基ずつを決定することに成功。そこで、これら12残基をT1R1の分子モデル上にマッピングすることで、マウス・ヒトT1R1/T1R3間でアミノ酸受容がどのように異なるかについての考察を行ったという。この考察から、ヒト型の"L-グルタミン酸受容に重要な残基"は、T1R1サブユニットの細胞外領域に存在するアミノ酸結合部位近傍に位置していることが判明し、中でも6残基中でL-グルタミン酸受容に最も決定的に影響を与える2つの残基については、分子モデルのアミノ酸結合部位内において上下対に存在していることを確認。これらの2つの残基は、マウスT1R1では酸性アミノ酸残基であるのに対し、ヒトT1R1ではアラニン残基になっていることから、マウスT1R1では、L-グルタミン酸結合時にこれらの酸性アミノ酸残基とL-グルタミン酸の側鎖のカルボキシル基との間で静電的な反発が生じることで、L-グルタミン酸活性が顕著に低下することが推察されたとする。またその一方でヒトT1R1は、これらの残基の負電荷が消失することに、より高いL-グルタミン酸活性を獲得したことが考えられたという。
一方、マウス型の"幅広いアミノ酸を受容するために重要な残基"については、アミノ酸結合部位とは離れた領域に存在することが判明したことから、これらの残基はアミノ酸の結合に直接関与するのではなく、受容体全体の活性調節に寄与していることが推察されたという。
これは、マウスT1R1/T1R3は受容体の活性がヒトと比べて高いため、多くのL-アミノ酸を受容することが可能になることを示すもので、これらの結果から、T1R1/T1R3のアミノ酸認識が「アミノ酸結合部位におけるアミノ酸選択性(L-グルタミン酸の結合しやすさ)」と「アミノ酸結合部位以外の領域で決定される受容体の活性の強さ」という、2つの異なる因子の組み合わせで決定されるという仮説が提唱されることとなった。
研究グループではこの仮説について、ヒト・マウス受容体のみならず、3種の非ヒト霊長類の受容体を用いた実験においても、その妥当性を支持することができたとしており、今後の霊長類がL-グルタミン酸に旨味を感じるようになった進化的・生理的意義の解明につながることが期待できるようになるとコメントしている。

